Badan Pengawas Obat dan Makanan (BPOM) RI menarik peredaran produk obat-obatan yang mengandung ranitidin karena diduga berpotensi memicu kanker.
Hal itu disampaikan melalui situs resmi pom.go.id serta media sosial Intagram @bpom_ri pada 4 Oktober lalu.
Keputusan penarikan ini berdasarkan informasi dari Badan Kesehatan Amerika, US FDA dan EMA (European Medicines Agency) tentang senyawa ranitidin yang terkontaminasi N-Nitrosodimethylamine (NDMA).N-Nitrosodimethylamine (NDMA) berpotensi memicu kanker.
Berikut penjelasan BPOM terkait ditariknya beberapa produk obat lambung ranitidin:
1. Ranitidin adalah obat yang digunakan untuk pengobatan gejala penyakit tukak lambung dan tukak usus.
2. Badan POM telah memberikan persetujuan terhadap ranitidin sejak tahun 1989 melalui kajian evaluasi keamanan, khasiat, dan mutu.
Ranitidin tersedia dalam bentuk sediaan tablet, sirup, dan injeksi.
3. Pada tanggal 13 September 2019, US FDA dan EMA mengeluarkan peringatan tentang adanya temuan cemaran NDMA dalam jumlah yang relatif kecil pada sampel produk yang mengandung bahan aktif ranitidin, dimana NDMA merupakan turunan zat Nitrosamin yang dapat terbentuk secara alami.
4. Studi global memutuskan nilai ambang batas cemaran NDMA yang diperbolehkan adalah 96 ng/hari (acceptable daily intake), bersifat karsinogenik jika dikonsumsi di atas ambang batas secara terus menerus dalam jangka waktu yang lama.
Hal ini dijadikan dasar oleh Badan POM dalam mengawal keamanan obat yang beredar di Indonesia.
5. Dalam rangka kehati-hatian, Badan POM telah menerbitkan Informasi Awal untuk Tenaga Profesional Kesehatan pada tanggal 17 September 2019 terkait Keamanan Produk Ranitidin yang terkontaminasi NDMA.
6. Badan POM saat ini sedang melakukan pengambilan dan pengujian beberapa sampel produk ranitidin.
Hasil uji sebagian sampel mengandung cemaran NDMA dengan jumlah yang melebihi batas yang diperbolehkan.
Pengujian dan kajian risiko akan dilanjutkan terhadap seluruh produk yang mengandung ranitidin.
7. Berdasarkan nilai ambang batas cemaran NDMA yang diperbolehkan, Badan POM memerintahkan kepada Industri Farmasi pemegang izin edar produk tersebut untuk melakukan penghentian produksi dan distribusi serta melakukan penarikan kembali (recall) seluruh bets produk dari peredaran (terlampir).
8. Badan POM akan terus memperbaharui informasi sesuai dengan data yang terbaru.
9. Sebagai bentuk tanggung jawab industri farmasi dalam menjamin mutu dan keamanan obat yang diproduksi dan diedarkan, industri farmasi diwajibkan untuk melakukan pengujian secara mandiri terhadap cemaran NDMA dan menarik secara sukarela apabila kandungan cemaran melebihi ambang batas yang diperbolehkan.
10. Masyarakat yang ingin mengetahui lebih lanjut tentang terapi pengobatan yang sedang dijalani menggunakan ranitidin, untuk menghubungi dokter atau apoteker.
Berikut adalah nama obat yang ditarik melalui perintah penarikan maupun dengan penarikan sukarela.
Perintah Penarikan Produk Ranitidin yang Terdeteksi N-Nitrosodimethylamine (NDMA):
1. Nama obat: Ranitidine cairan injeksi 25 mg/mL
Nomor bets produk beredar:
– 95486 160 s/d 190
– 06486 001 s/d 008
– 16486 001 s/d 051
– 26486 001 s/d 018
Pemegang izin edar: PT Pharos Tbk
Penarikan Sukarela Produk Ranitidin yang Terdeteksi N-Nitrosodimethylamine (NDMA):
1. Nama obat: Zantac Cairan Injeksi 25 mg/mL
Nomor bets produk beredar:
– GP4Y
– JG9Y
– XF6E
Pemegang izin edar: PT Glaxo Wellcome Indonesia
2. Nama obat: Rinadin Sirup 75 mg/5 mL
Nomor bets produk beredar:
– 0400518001
– 0400718001
– 0400818001
Pemegang izin edar: PT Global Multi Pharmalab
3. Nama obat: Indoran Cairan Injeksi 25 mg/mL
Nomor bets produk beredar:
– BF 171 008
Pemegang izin edar: PT Indofarma
4. Nama obat: Ranitidine Cairan Injeksi 25 mg/mL
Nomor bets produk beredar:
– BF 171 009 s/d 021
BPOM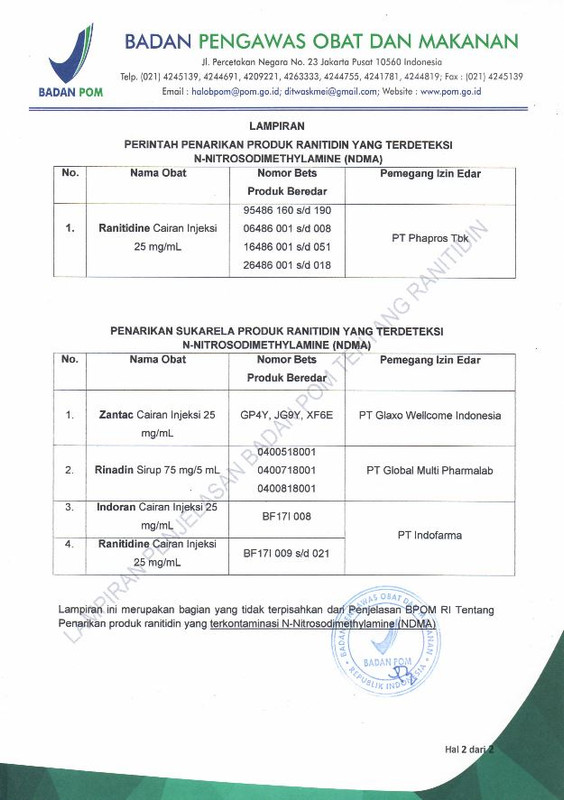
BPOM menyarankan pasien yang masih mengonsumsi ranitidin untuk menghubungi dokter atau apoteker.